對生豬養殖業而言,非洲豬瘟是當前最具危險性的傳染疾病之一自2018年冬季傳入我國以來以對我國生豬養殖業帶來了巨大損失。非洲豬瘟是由非洲豬瘟病毒(African swine fever virus,ASFV)引起的一種高度接觸性,致死率極高的烈性傳染病。由于非洲豬瘟臨床癥狀與豬瘟(CSF)和豬繁殖與呼吸障礙綜合征(PRRS)等病癥極其相似,所以僅通過臨床癥狀無法區分,因此需要使用分子生物學手段對非洲豬瘟病毒進行檢測,以做到對非洲豬瘟病毒及時、快速、準確的診斷,以確保將非洲豬瘟的威脅性降到最低。筆者將簡述目前常見的非洲豬瘟病毒檢測方法及注意事項,以期為生豬養殖從業人員在非洲豬瘟病毒檢測及非瘟防控提供參考。
1 非洲豬瘟病毒檢測方法
1.1 病原學檢測
ASFV的病原學檢測,主要有聚合酶鏈式反應(PCR)、微滴數字PCR(Droplet Digital PCR, ddPCR)、線性指數PCR、重組酶聚合酶擴增技術(RPA)、原位雜交技術(ISH)、環介導恒溫擴增技術(LAMP)、探針雜交技術等。
PCR檢測:PCR是疫病最早期采用的檢測方法,非洲豬瘟病毒的PCR檢測是根據其基因中的高度保守區序列,設計特異性引物進行擴增,檢測和鑒定屬于所有已知病毒基因型的廣泛分離株。依據世界動物衛生組織推薦的的PCR檢測方法,可以擴增出22株不同的ASFV病毒,但傳統PCR方法由于耗時較長且對設備要求高,因此并未廣泛應用于養殖一線。
巢式PCR:采用內外兩對PCR引物,可以在檢測組織、血液樣品和培養物的基礎上,檢測昆蟲體內所帶的ASFV。巢式PCR克服了單次擴增平臺期效應的限制,使擴增倍數提高,從而極大的提高了PCR的敏感性;并且因為模板和引物的改變,降低了非特異性反應連續放大進行的可能性,保證了反應的特異性;由于內側引物擴增的模板是外側引物擴增的產物,第二階段反應能否進行,也是對第一階段反應正確性的鑒定,因引此可以保證整個反應的準確性及可行性。
熒光定量PCR:熒光定量PCR是在常規PCR基礎上對某些特定基因如p72、p54、K205R等設計引物和探針,使得檢測特異性和敏感性得到了較大的提升。非洲豬瘟傳入中國以來,由于部分豬場已經出現CSFV、ASFV以及PRRSV混合感染的情況。因此,利用多重PCR技術不但可對混合感染的豬只做及時和準確的診斷,而且還能極大程度減少檢測耗材的使用,縮短檢測時間。
微滴數字PCR檢測:ddPCR比普通熒光定量具有更高的敏感性和特異性,其采用終點稀釋方法實現了最小劑量單分子病毒的擴增,進而計算出樣品的起始濃度,最終達到對病毒含量的絕對定量。但由于微滴數字PCR需要使用較為昂貴的儀器設備和試劑,因此很難用于大規模樣品的檢測。
環介導等溫擴增技術:是一種“簡便、快速、精確、低價”的基因擴增技術,可做到快速檢測非洲豬瘟病毒,通常30分鐘即可完成檢測。與常規PCR相比,環介導等溫擴增不需要模板的熱變性、溫度循環、電泳及紫外觀察等過程,因此對儀器設備的要求較低,便于在養殖場、屠宰場、飼料廠進行快速檢測,該檢測方法也是目前生產一線最常用的非洲豬瘟病毒檢測方法之一。
重組聚合酶擴增技術:重組聚合酶擴增技術是一種新興的分子學檢測方法,目前也被應用于ASFV的檢測中,其原理類似于體內的DNA的復制過程,通過生成重組酶-DNA復合物來啟動DNA的合成,進而進行目標區域的指數式擴增。由于RPA的反應溫度介于37-42℃之間,舍去了常規實時熒光定量技術中加熱到退火的過程,所以其反應時間可以縮短至20分鐘左右。該方法在保證了擴增敏感性和特異性的同時,又極大的縮短了檢測時間。
下圖為實時熒光定量技術檢測非洲豬瘟病毒的基本原理(圖1)。
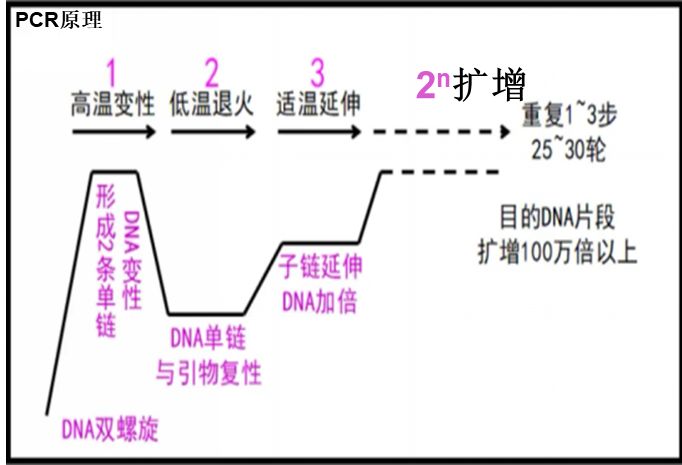
圖 1實時熒光定量技術原理
1.2 血清學檢測
利用抗原抗體反應進行的抗原檢測和抗體檢測,是血清學檢測的兩種重要手段。針對ASFV抗原的檢測方法主要有熒光抗體試驗、雙抗夾心酶聯免疫吸附試驗、膠體金免疫層析法等;針對ASFV抗體的檢測方法主要有酶聯免疫吸附試驗(ELISA)、間接熒光試驗、膠體金免疫層析技術等。
血清學抗原檢測:目前世界動物衛生組織推薦的用于抗原鑒定的方法為熒光抗體試驗,主要用于鑒定不產生紅細胞吸附試驗反應的非洲豬瘟病毒毒株,通過熒光標記單抗而檢測動物組織內的抗原;在ELISA基礎上發展起來的雙抗夾心ELISA方法,運用抗原抗體特異性結合原理,先將特異性抗體與固相載體結合,在此基礎上加入待檢抗原,然后加入酶標抗體,使得一單位的抗原同時結合兩個單位的抗體從而形成所謂的“雙抗體夾心”,最后加入底物試劑與酶標抗體結合,根據顯色深淺來判斷抗原含量。此外,ASFV的交叉引物擴增結合免疫層析快速檢測方法,不僅方便快捷,且有著良好的敏感性。免疫膠體金技術是一種常用的標記技術,而膠體金免疫層析法則是運用類似于側向流動免疫色譜分析的虹吸原理,來檢測樣品中抗原的有無,適合快速檢測和流行病學調查。
血清學抗體檢測:抗體檢測是血清學檢測中最常規的方法,目前針對p72、p30、p54、K205R等ASFV蛋白,國內外都已建立了間接ELISA、競爭ELISA、阻斷ELISA等多種方法。目前市場上已有很多商品化ELISA試劑盒,特異性與靈敏度都非常高,是人們進行ASFV檢測時的首選方法。同時,免疫膠體金技術針對包被分子的不同也可以用來檢測ASFV抗體,該兩種方法均是生產一線中快速診斷非洲豬瘟的方法之一。
2 非洲豬瘟病毒檢測注意事項
非洲豬瘟病毒檢測涉及樣本采集、樣本保存、樣本運輸、樣本處理與最終檢測等多個環節,一個環節出現紕漏,就極易出現假陽性或者假陰性的錯誤檢測結果。提高檢測可靠性,避免出現假陽性或者假陰性結果,我們需要做到以下幾點。
2.1 樣品端
規范樣本采集操作。隨機采樣時要注意仔細觀察豬的精神狀態,對精神狀態不好伴有發燒癥狀的豬只要重點采集確保不漏任何一頭;或者隨機采樣時,對全群豬只進行間隔采集,保證不漏采任何一頭疑似豬只。當采集的樣品為組織樣時,應將樣品50%中性甘油溶液或含I00 μg/mL青霉素和鏈霉素的PBS溶液中,樣品采集完成后要置于低溫環境中保存和運輸(12h內可4℃環境中運輸),到達實驗室至檢測前應將樣品置于-20℃中保存,以保證檢測結果的準確性。
2.2 試劑端
規范化檢測試劑的保存。很大一部分假陽性與假陰性的檢測結果,是由于檢測試劑保存不當造成的。因此我們要規范化檢測試劑的管理,做好試劑的生產日期及失效日期登記,并將試劑保存在適宜的環境中。
2.3 病毒檢測端
病毒檢測過程中若存在不符合操作規程的地方也會導致檢測結果出錯。核酸檢測是微量操作,要求極為嚴格。首先,要做好檢測人員的專業知識和實操技能的培訓,保證檢測人員在樣品處理端和加樣端的操作符合規程。另外樣品RNA提取和逆轉錄的過程對操作人員的加樣速度、超純水以及潔凈度要求較高,如果環境中存在RNA酶則會使RNA降解從而導致檢測結果出錯。因此,在病毒檢測端在保證操作環境潔凈的同時一定要確保檢測人員有著較高的實驗室素養和實操水平。
3 總結
雖然分子生物學檢測非洲豬瘟病毒是診斷非洲豬瘟疾病最有效的、最便捷、最準確的方法,但是要確保檢測結果的真實可靠就一定要將病毒檢測過程中每一個操作步驟都執行到位,準確可靠的結果能有效防止非洲豬瘟的進一步擴散,降低非洲豬瘟對生豬養殖業的威脅。